Все публикации -> Раздел: Брюшная полость -> Тема: Патология печени
Трансплантация донорской печени у кошек и собак.
Российский университет дружбы народов
Аграрный факультет
Кафедра анатомии, физиологии и хирургии животных
Выпускная квалификационная работа
Ортотопическая трансплантация донорской печени у кошек и собак в терминальной стадии заболевания
|
Исполнитель: |
студентка V курса специальности Ветеринария Мордас Е.М. |
|
Научный руководитель: |
кандидат ветеринарных наук, старший преподаватель Воронцов А.А. |
|
Заведующий кафедрой: |
доктор ветеринарных наук, профессор Ватников Ю.А. |
Москва – 2009
Содержание
|
I. СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ |
3 |
|
II. ВВЕДЕНИЕ |
4 |
|
III. ОБЗОР ЛИТЕРАТУРЫ |
8 |
|
3.1. Анатомия печени |
8 |
|
3.1.1. Клиническая физиология печени |
13 |
|
3.1.2. Патологическая физиология печени |
16 |
|
3.2. Болезни печени как показания к трансплантации |
23 |
|
3.3. Хирургическое лечение (трансплантация донорской печени) |
28 |
|
3.4. Заключение |
33 |
|
IV. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ |
34 |
|
4.1. Материалы и методы исследования |
34 |
|
4.1.2. Клиническое исследование животных |
35 |
|
4.1.2. Лабораторные и инструментальные методы исследования |
36 |
|
4.1.2.1. УЗИ метод диагностики |
36 |
|
4.1.2.2. Пункционная биопсия печени |
38 |
|
4.2.Трансплантация донорской печени |
40 |
|
4.2.1. Подготовка животного к трансплантации |
40 |
|
4.2.2. Проведение общей анестезии и мониторинг |
41 |
|
4.2.3. Операция у донора |
43 |
|
4.2.4. Операция у реципиента кошки |
47 |
|
4.2.5. Операция у реципиента собаки |
52 |
|
4.2.6. Постоперационный период и иммуносупрессивная терапия |
58 |
|
V. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ |
59 |
|
VI. ЗАКЛЮЧЕНИЕ |
66 |
|
VII. ВЫВОДЫ |
67 |
|
VIII. УКАЗАТЕЛЬ ЛИТЕРАТУРЫ |
68 |
I. СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ
АД – артериальное давление
БХ – биохимический анализ крови
ВВШ – вено-венозное шунтирование
ВД – венозное давление
ОКА – общий клинический анализ крови
ТДП – трансплантация донорской печени
УЗИ – ультразвуковое исследование
ЭКГ – электрокардиограмма
ЭХО КГ– ультразвуковое исследование сердца
II. ВВЕДЕНИЕ
Печень играет незаменимую и жизненно важную роль в обмене веществ организма, а также в обезвреживании, выведении токсических продуктов метаболизма. Она обладает значительными функциональными резервами, поэтому клинические проявления недостаточности функции органа, как правило, проявляются при поражении от 70 до 85% паренхимы органа [3, 9, 21].
По современным данным заболевания печени у кошек и собак составляют от 5 до 12% среди незаразных болезней, которые регистрируются у данных животных [52].
На сегодняшний день представления об острых и хронических патологических процессах в печени дают возможность использовать не только объективные методы диагностики, такие как прицельная пункционная биопсия, компьютерная томография, сцинтиграфия, магнитно-резоанстная томография, но и определять тактику дальнейшего лечения.
Стадийность и тяжесть проявления печёночной недостаточности, особенно при патологиях в терминальных стадиях требует использования заместительных и объективных методов лечения.
В настоящее время консервативная медикаментозная терапия в тяжёлых стадиях проявления заболеваний печени не отвечает требованию данной патологии, а сроки и качество жизни больных животных не удовлетворительны [1, 13, 22].
Данные, которые посвящены возможности консервативного лечения терминальных стадий, заболевания свидетельствуют о неблагоприятном прогнозе [22, 40, 45, 57].
Во всём мире в медицине у человека в подобных стадиях проявлений печёночной недостаточности принято использовать единственный радикальный метод заместительной терапии, такой как трансплантация донорской печени [2, 6, 14].
Актуальность темы. Существует ряд патологий печени у кошек и собак, которые характеризуются необратимостью течения заболевания с фатальным прогнозом и тяжёлыми клиническими проявлениями в виде желтухи, асцита и энцефалопатии. К таким заболеваниям относят декомпенсированную стадию жировой дистрофии печени у кошек, фульминантный печёночно-клеточный некроз, цирроз (фиброз), склерозирующий холангит, некоторые новообразования печени, портосистемные интрагепатические шунты и другие редкие проявления патологий печени [19, 22, 24, 30, 34, 45].
Всё это заставляет думать о возможности и необходимости проведения трансплантации донорской печени (ТДП) в клинической практике терминальных стадий заболевания у кошек и собак, как единственной возможности сохранения жизни больного животного.
Трансплантация донорской печени в основном принята в клинической практике у человека и на сегодняшний день в мире выполнено более 200 тыс. операций [4].
Первая ортотопическая ТДП у человека была выполнена американским хирургом T.E. Starlz в 1963 году, и прошло более сорока лет [56].
Операция по ТДП на сегодняшний день считается одной из самых сложных операций в анатомическом, физиологическом и биологическом отношениях [38].
Первые попытки ТДП в эксперименте предпринимались с середины 50-х годов. При этом разрабатывались два принципиально различных варианта ТДП – ортотопическая (имплантация в позицию удалённой печени) и гетеротопическая (имплантация в неанатомическое место) [8, 21, 27]. Модели ТДП в различных вариантах были разработаны для собак, свиней, крыс и обезьян [5, 7, 56, 59].
Свои возможности проведения трансплантации сердца и печени в клинической ветеринарной практике описал С. R. Gregory в 1993 году [29].
Внедрение в клиническую ветеринарную практику ТДП у кошек и собак, возможно, помогут нам решить самые сложные вопросы в лечении терминальных стадий заболеваний печени и сохранят жизнь нашим пациентам.
На сегодняшний день отсутствует общепринятая методика ТДП у животных. Поэтому поиск возможности, объективности и последующего лечения при проведении трансплантации донорской печени у кошек и собак определяет актуальность проблемы.
Цель работы. Изучить практические аспекты диагностики терминальных стадий заболеваний печени, которым требуется заместительная терапия в виде трансплантации органа. Определить и отработать тактику проведения трансплантации донорской печени с учётом исходных клинических, хирургических и иммунологических особенностей проведения оперативного вмешательства.
Задачи исследования.
1. Определить основные показания к проведению ТДП у кошек и собак.
2. Выявить особенности подготовки и проведения ТДП.
3. Оценить возможности и определить принципиальные отличия проведения оперативного вмешательства по поводу ТДП.
4. Отработать тактику последующей клинической и иммунологической терапии после ТДП донорской печени.
Научная новизна. Определены показания и предложен принципиально новый метод заместительной терапии некоторых терминальных стадий печёночной недостаточности у кошек и собак.
Изучены гемодинамические и патофизиологические аспекты проведения ТДП у кошек и собак.
Практическая значимость. В результате выполнения практической работы определены методические подходы в диагностике заболевания, отработаны методы проведения оперативного вмешательства у кошек и собак. Определена хирургическая тактика и отработаны методы проведения ТДП у кошек и собак с использованием вено-венозного обходного шунтирования (ВВШ) и без него.
IV. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
4.1. Материалы и методы исследования
Материалы и методы. Работа выполнена в условиях клинического приема в период с 2007 по апрель 2009 года. Материалом нашего исследования явились 2 собаки и 7 кошек, которым была проведена ортотопическая трансплантация донорской печени в терминальной стадии печеночной недостаточности. Возраст представленных животных колебался от 6 до 9,5 лет в среднем 7,9±0,4 года.
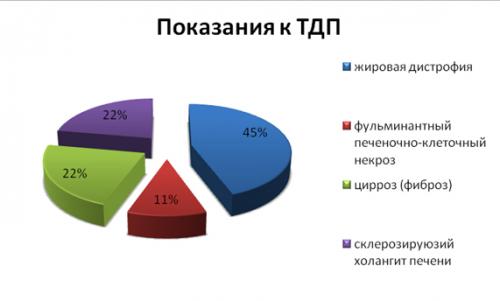
Основным показанием к ТДП явились: жировая дистрофия (n-4), фульминантный печеночно-клеточный некроз (n-1), цирроз (фиброз) (n-2) и склерозирующий холангит печени (n-2) (диаграмма).
|
Противопоказаниями к проведению ТДП относили сопутствующие патологии: инфекции, новообразования внепечёночного происхождения.
4.1.2. Клиническое исследование животных
Диагностику заболевания проводили с использованием комплексного подхода. При сборе анамнеза больного животного с терминальными стадиями заболеваний печени акцентировали внимание на наличие перенесенных ранее заболеваний, хронических текущих проявлений патологий печени и неспецифичным симптомам.
Клинически животные имели признаки снижения или отсутствие аппетита со слов владельцев, кахексичный вид, иктеричность видимых слизистых оболочек, вялость. Исключение составляли две кошки, у которых в последующем был выявлен и подтвержден диагноз жировая дистрофия печени.
В основном животные поступали к нам из других лечебных учреждений, где по месту лечения проходили курс консервативной терапии в разные сроки.
Всем животным, после нашего подтверждения диагноза, мы дополнительно рекомендовали некоторые схемы консервативной терапии, которые предполагали: коррекцию водно-электролитного и кислотно-основного баланса (Рингер Локка, Трисоль, Дисоль), дезинтоксикационную (Реамберин), использование противовоспалительных (Преднизолон), гепатопротективных (Эссенциале, Хофитол, Карсил, Гептрал, Гепамерц, Урсофальк) препаратов. Дополнительно проводился курс антибиотикотерапии.
У всех животных на момент проведения ТДП отмечали невосприимчивость к консервативной терапии, а сроки нашего лечения составили от 12 до 134 в среднем 56±13,8 суток.
4.1.2. Лабораторные и инструментальные методы исследования
Для постановки окончательного диагноза и принятия решения о проведении трансплантации донорской печени использовали дополнительно лабораторные и инструментальные методы диагностики (ЭКГ, УЗИ, рентгенографию, прицельную пункционную биопсию).
Изменения в биохимических показателях крови при проведении лабораторного исследования свидетельствовали о тяжелой форме печеночной недостаточности (табл. 1).
Таблица 1.
Основные исходные биохимические показатели крови у кошек и собак.
|
Показатели крови (БХ)
|
Кошки до операции n=7 |
Собаки до операции n=2 |
|
Билирубин общий мкмоль/л |
53±7,0 |
46 и 31 |
|
Билирубин прямой мкмоль/л |
22,8±3,0 |
17 и 23 |
|
АЛТ Е/л |
278±101 |
84 и 59 |
|
ГГТ Е/л |
20,8±2,6 |
19 и 32 |
|
Мочевина моль/л |
8,7±1,1 |
8 и 5 |
|
Креатинин мкмоль/л |
139±10,1 |
132 и 162 |
|
Щелочная фосфатаза |
489±8,7 |
415 и 894 |
4.1.2.1. УЗИ метод диагностики
Ультразвуковое исследование печени и желчевыделительной системы проводили на аппарате ультразвуковой диагностики SONOACE 8000 ЕX. Основное внимание уделяли размерам, структуре и наличию свободной жидкости в брюшной полости. Для оценки состояния ангиоархитектоники использовали дуплексное сканирование сосудов печени.
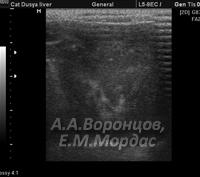
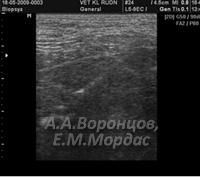
При проведении ультразвуковой диагностики печени у кошек с подозрением на жировую дистрофию отмечали картину равномерной крупнозернистой гипоэхогенности, контуры желчного пузыря нечеткие, признаки воспаления отсутствовали (рис. 4).
При диагностике фульминантного печеночно-клеточного некроза отмечали резкое увеличение органа в размерах, паренхима неоднородна, гипоэхогенна, края сглажены с плохо визуализируемой капсулой, кровеносные сосуды резко расширены (рис. 5).
|
|
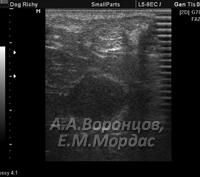
Цирроз (фиброз) характеризовался специфической ультразвуковой картиной, где эхогенность была резко повышена, структура неоднородна, а контуры органа неровные, где капсула практически не дифференцировалась. Отмечалась свободная жидкость в брюшной полости. На этапе подготовки животного к проведению ультразвукового исследования отмечали характерный сосудистый рисунок на коже живота в виде «головы медузы», что свидетельствовало о портальной гипертензии (рис. 6).
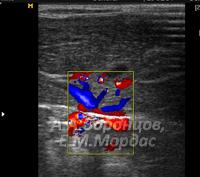
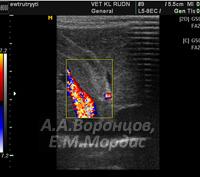
У животного со склерозирующим холангитом отмечали резко выраженные гиперэхогенные структуры билиарного тракта паренхимы печени в виде желчных протоков. Проводили дифференциальную диагностику на наличие изменений сосудистой структуры, используя дуплексное сканирование (рис. 7).
|
|
4.1.2.2. Пункционная биопсия печени
В последующем у всех животных выполнялась трансабдоменальная прицельная биопсия печени полуавтоматической биопсийной иглой SLB с диаметром 18G.
Биопсию печени выполняли без проведения общего наркоза под инфильтрационной анестезией по Вишневскому.
Животное на столе располагали в положении на спине, асептически подготавливали кожу в области мечевидного отростка и паракостальной зоны. Транскутанно под контролем УЗИ вводили биопсийную иглу в паренхиму печени (рис. 8 а, б).
Хранили биопсийный материал до морфологического исследования в 10% формалине.
|
|
После подтверждения диагноза на основе клинико-морфологической картины оценивали общий клинический статус животного и рекомендовали проведение ортотопической ТДП.
4.2.Трансплантация донорской печени
4.2.1. Подготовка животного к трансплантации

|
Рис. 9. Проведение процедуры лапароцентеза при портальной гипертензии и асците |
Подготовка к проведению ТДП была направлена на возможную коррекцию функционального состояния печени используя гепатопротективную и противовоспалительную терапию. В случаях выраженной портальной гипертензии с формированием асцита проводили декомпрессионный лапароцентез (рис. 9).
Стабилизировали водно-электролитный, кислотно-основной баланс и коллоидный с использованием кристалоидных физиологических растворов и альбумина. У одного животного (собака) проводили курс плазмафереза дважды с интервалом 24 часа для коррекции тяжёлой билирубинемии. (Плазмаферез – операция экстракорпоральной детоксикации, заключающаяся в удалении части плазмы крови вместе со всеми растворенными в ней веществами (в т.ч. токсинами)).
Использовали безаппаратный метод, в основе которого лежала перфузия крови в замкнутом экстракорпоральном контуре, состоящем из кровопроводящих магистралей и специального плазмофильтра в котором происходило разделение крови на плазму и форменные элементы. Форменные элементы при этой методике оставались в контуре и в последующем возвращались к пациенту. Выделенная плазма с билирубином и токсинами удалялась и замещалась.
Для пламафереза использовали плазмофильтр ПФМ-01-ТТ «РОСА». При проведении процедуры необходима была одна вена и максимального диаметра канюля 16G.
Животное проводили процедуру в течение 40-43 мин, выделенную и удалённую плазму замещали плазмозамещающим раствором HAES 6% в удвоенном объёме от выделенной плазмы (рис. 10 а, б).
|
|
4.2.2. Проведение общей анестезии и мониторинг
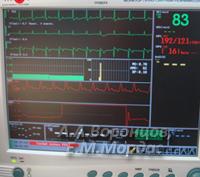
Оперативные вмешательства осуществлялись в условиях общей анестезии с расширенным мониторированием (ЭКГ, оценкой инвазивного артериального, центрального венозного давления, анализа гемокоагуляции, электролитного, газового состояния крови) и искусственной вентиляции лёгких.
Хирургическая тактика ТДП включала в себя 3 этапа:
1. Извлечение, консервация и подготовка донорского органа.
2. Удаление собственного органа.
3. Имплантация донорской печени и гемостаз.
Премедикация перед проведением общей анестезии включала: атропин 0,1% в дозе 0,05 мг/кг, преднизолон 10 мг/кг, гордокс 20000 КИЕ, антибиотик широкого спектра действия.
Общую анестезию обеспечивали схемой: Пропофол в/в 1-3 мг/кг/час, Фентанил в/в 0,1- 0,2 мг/кг, Золетил в/в 0,1-1 мг/кг, Мидозолам (Дормикум) 0,3-0,5 мг. Артериальное давление измеряли, установив предварительно, катетер в бедренную артерию путём открытого секционного выделения у кошек и закрытым путём у собак. Центральное венозное давление контролировали после установки катетера в ярёмную вену и правое предсердие (рис. 11 а, б).
|
|
После проведения гепатэктомии у реципиента обычно дозы введения анестетика значительно сокращались, в виду нарушения метаболической функции печени в беспечёночном периоде. Одновременно после оценки кровопотери в операционной ране во время оперативного вмешательства у реципиента проводили гемотрансфузию. Использовалась донорская кровь от животного донора. Интраоперационно контролировали уровень глюкозы, КЩС, и основные электролиты на аппарате GEM Premier 3000 (рис. 12).
|
4.2.3. Операция у донора
Отбор донора и операция
Потенциальными донорами являлись животные, у которых были выявлены патологии несовместимые с жизнью и которых владельцы по собственному желанию хотели эутаназировать.
Отбор донора предполагал проведение первичного клинико-лабораторного, ультразвукового исследования печени и сосудов. У собак проводили дополнительно возможность совпадения размеров органа по антропометрическим данным.
Затем проводили оценку групповой совместимости крови лимфоцитотоксической (реакция cross-mаtch) на наличие предсуществующих антител (рис. 13 а, б; 14 а, б).
|
| ||||
|
|
Донорский этап является не менее сложным и значимым при ТДП.
После проведения общей анестезии животное (кошка, собака) укладывались на операционный стол в положении на спине.
Подготавливали операционное поле по общепринятым методикам в хирургии и проводили широкую лапаротомию.
В брюшной полости начинали мобилизацию общего желчного протока и воротной вены в каудальном направлении от печени до двенадцатипёрстной кишки.
У кошек особое внимание уделяли на осторожность препаровки воротной вены. Затем пересекали общий желчный проток в проксимальной части и приступали к мобилизации печёночной артерии.
У собак сначала лигировали и пересекали печеночно-двенадцатипёрсную часть артериального ствола, а затем отсекали печёночную артерию в области перехода в чревный ствол с частью последней.
У кошек проводили мобилизацию артерии с чревным стволом и участком брюшной аорты, что определяло сложность процедуры. После пересечения печеночно-двенадцатипёрсной части проводили препаровку чревной и краниальной брыжеечной части. Затем лигировали и пересекали последнюю на месте отхождения от брюшной аорты. Следующим этапом было лигирование и пересечение каудальной брыжеечной и почечных артерий.
Последним этапом в подготовки сосудов печени явилась мобилизация позадипечёночной части каудальной полой вены, правого надпочечника и пересечение связочного аппарата печени.
Завершающим этапом явилась канюляция воротной вены, пережатие предпечёночной части каудальной полой вены, пересечение позадипечёночной части и перфузирование печени охлаждённым до 4 ºС консервирующим раствором “Custodiol” через воротную вену. У кошек в двух случаях проводили перфузию через артерию с использованием каудальной части брюшной аорты, которую предварительно канюлировали.
Воротную вену пересекали одновременно с каудальной полой. Расстояние между операционным столом и ёмкостью с консервантом составляло 100 см. Сроки консервации от 179 до 311 в среднем 224±13,7 минут (рис. 15 а, б).
|
Warning: Use of undefined constant SCRIPT_NAME - assumed 'SCRIPT_NAME' (this will throw an Error in a future version of PHP) in /home/vetchiru/vetchirurg.ru/docs/c3.php on line 13 Портосистемные шунты
Врожденные экстрагепатические шунты у собак
Трансплантация сердца у собаки
Трансплантация сердца у собаки Хилоторакс
Хилоторакс у кошки Эндоскопическое лечение
|
Все права защищены, при использовании материалов сайта, ссылка на источник обязательна.